Переработка
Использованные и непригодные для работы батарейки представляют опасность, если держать их в доме
Переработка и вторичное использование аккумуляторов стало важной проблемой последних лет. Из всего количества произведенных источников тока переработке подвергаются лишь 3%
Самое большое количество перерабатывается в Австралии — около 80%. В Америке и странах Европы 60% и 30% соответственно. В России и других развивающихся странах не особо задумываются о важности переработки, поэтому батарейки выбрасывают в контейнеры с бытовыми отходами.
Процесс переработки батарей:
- Сортировка гальванических элементов по составу и количеству заряда.
- Удаление окисления горючих материалов с помощью газовых установок.
- Частицы, которые появились в результате горения, удаляются, а затем выпускаются в атмосферу.
- Оставшиеся очищенные элементы расщепляются на кусочки и плавятся.
- В итоге вещества неметаллического происхождения сжигают, а оставшийся шлак удаляется.
- Сплавы жидкой консистенции распределяются по весу и разделяются.
Переработка в разных странах
На переработку батарей и аккумуляторов требуется в 10 раз больше энергии, чем на их производство. Чтобы этот процесс не влиял на бюджет страны, были созданы правила и сборы.
В Германии на переработку ежегодно поступает 100 тысяч тонн отходов. Страна использует метод пирометаллургической переработки. Он позволяет осуществлять переработку больших объемов материала. Однако качество переработанного сырья становится хуже.
В Европейском союзе стоимость переработки уже включена в стоимость самой батареи. Если покупатель сдаёт использованные гальванические элементы, то получает скидку на покупку новых.
Россия не занималась переработкой источников тока до 2014 года. На одном из заводов Челябинска появилась перерабатывающая линия, на которой используется гидрометаллургический метод. В 2014 году на переработку в общей сложности было отправлено около 18 тонн использованных источников тока. За 1 год завод может переработать 15 тонн отходов. При этом на восстановленный материал приходится 80% .Ранее в стране находились предприятия только для хранения использованных батарей, так как переработка стоила дорого.
Батарейки — это источники тока, которые значительно облегчили жизнь людей. Без их существования была бы невозможна работа устройств, используемых в повседневной жизни. Гальванические элементы существуют разных видов и размеров, поэтому каждый подберет подходящий своему случаю
Однако важно помнить о том, что батарейки очень опасны для здоровья и жизни. Необходимо научиться правильно их утилизировать и никогда не хранить в доме
Вам также может быть интересно .

Батарейки 0
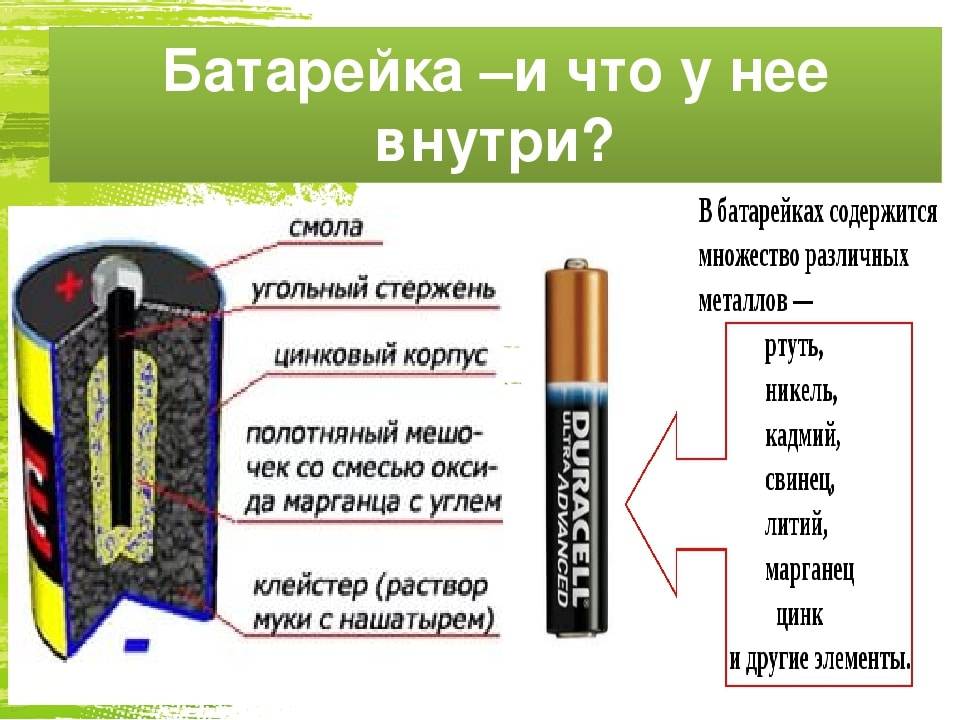
Из чего делают батарейки
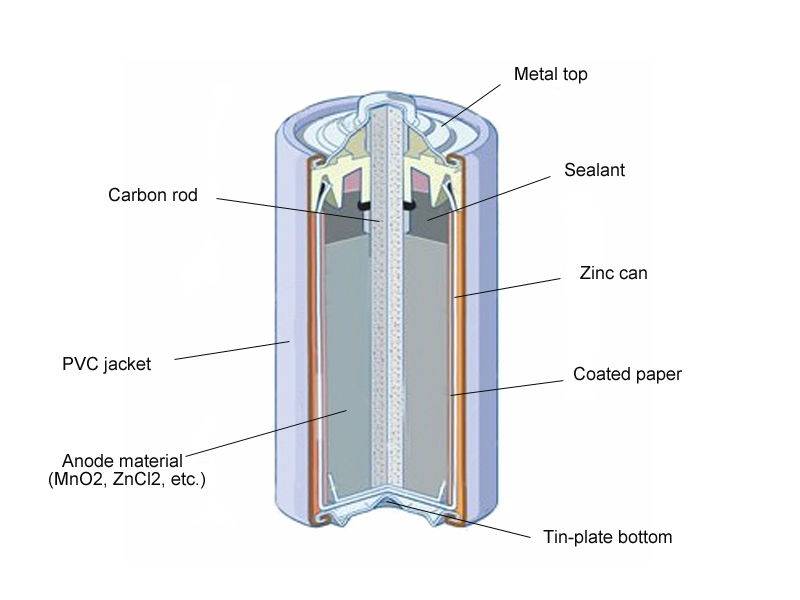
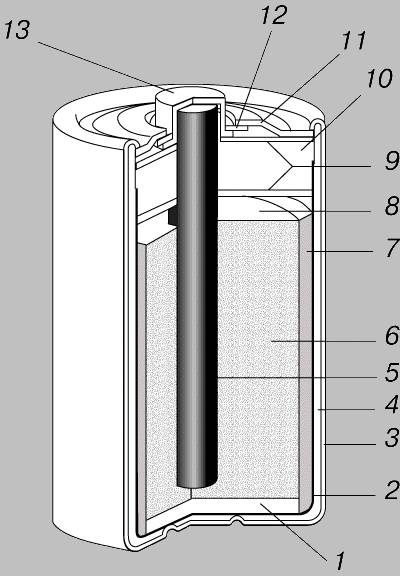
Существует четыре типа элементов питания. Несмотря на то что принцип работы у них одинаковый, все источники тока имеют уникальную конструкцию и состоят из разных деталей.
«Пальчиковые» и «мизинчиковые» батарейки
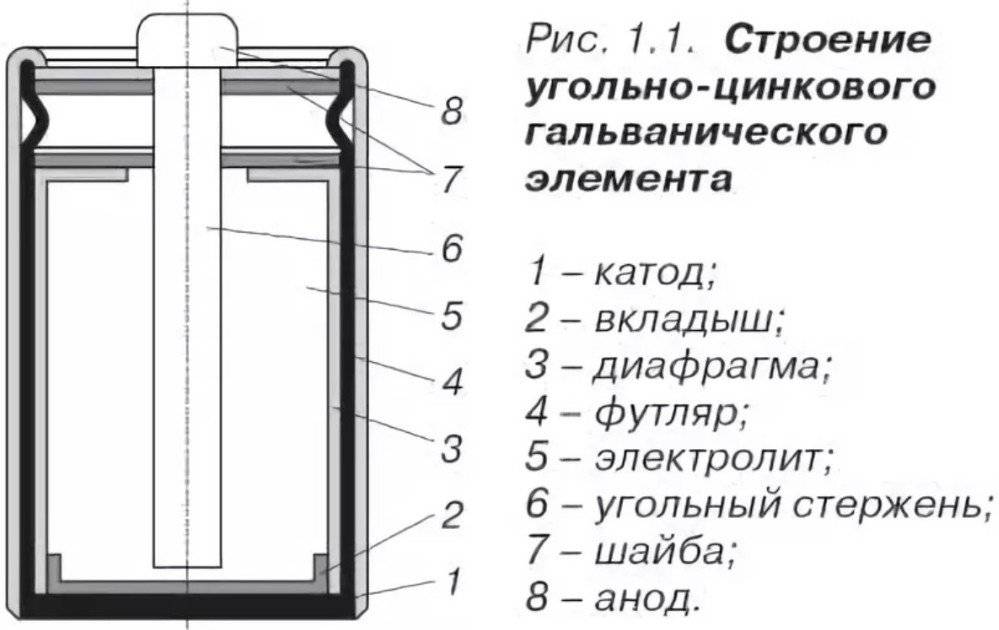
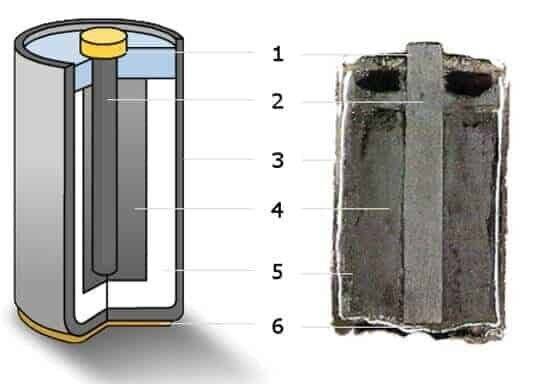
«Пальчиковые» и «мизинчиковые» источники тока представляют собой цилиндр небольшого размера. Это одни из самых распространённых вариантов батареек. Они состоят из следующих элементов:
- отрицательного заряда — катода;
- вкладыша, выполняющего роль своеобразной прокладки;
- корпуса;
- мембраны;
- электролита, обеспечивающего нормальное протекание химической реакции;
- стержня, изготовленного из углеродистого соединения, например, угля или сажи;
- фиксирующей шайбы;
- положительного заряда — анода.
Это стандартная конструкция большинства цилиндрических батареек. Но есть устройства, состоящие из стержня, изготовленного из угля, металлических деталей и специального порошка.
Из чего состоит круглая батарейка
Элемент питания, имеющий необычную приплюснутую форму, ещё называют «таблетка». Чаще его используют в часах и различных сигнализациях. Он состоит из следующих элементов:
- анода — его роль выполняет одна из крышек;
- катода — отрицательным контактом служит вторая крышка;
- прокладки, дополнительно пропитанной электролитом;
- диоксида ртути;
- цинкового порошка;
- водонепроницаемого слоя;
- кольца, обеспечивающего надёжную герметизацию.
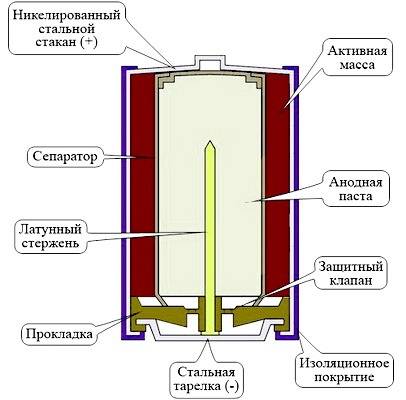
Батарея сотового телефона
Конструкция элемента питания сотового телефона несколько сложнее, чем устройство обычных батареек. В неё входят:
- положительный и отрицательный контакт;
- анодный корпус;
- катодный стакан;
- уплотняющее вещество;
- сепаратор;
- изолирующий состав;
- защитная мембрана;
- диафрагма;
- корпус из алюминия или другого металла.
Из чего состоит «крона»
Источник питания прямоугольной формы конструктивно отличается от других батареек. Положительный и отрицательный контакт находятся друг над другом. Располагаются они в верхней части устройства. Снизу находится основа, выполненная из пластмассы. От минусового контакта отходит пластина, которая фиксируется на минусовом полюсе.
Корпус устройства выполнен из металла. Внутри него располагаются шесть небольших приплюснутых прямоугольников, каждый из которых — индивидуальная батарейка. Заряд такого «бочонка» составляет 1,5 В. Между пластинами находится ещё одна — специальная.
Строение источника питания достаточно простое:
- два контакта — положительный и отрицательный;
- корпус из алюминия или другого металла;
- две пластины из пластика;
- шесть соединённых между собой «бочонков» по 1,5 вольт каждый;
- стержень из углеродистого соединения;
- пластины для изоляции «бочонков»;
- плёнка;
- внешняя оболочка.
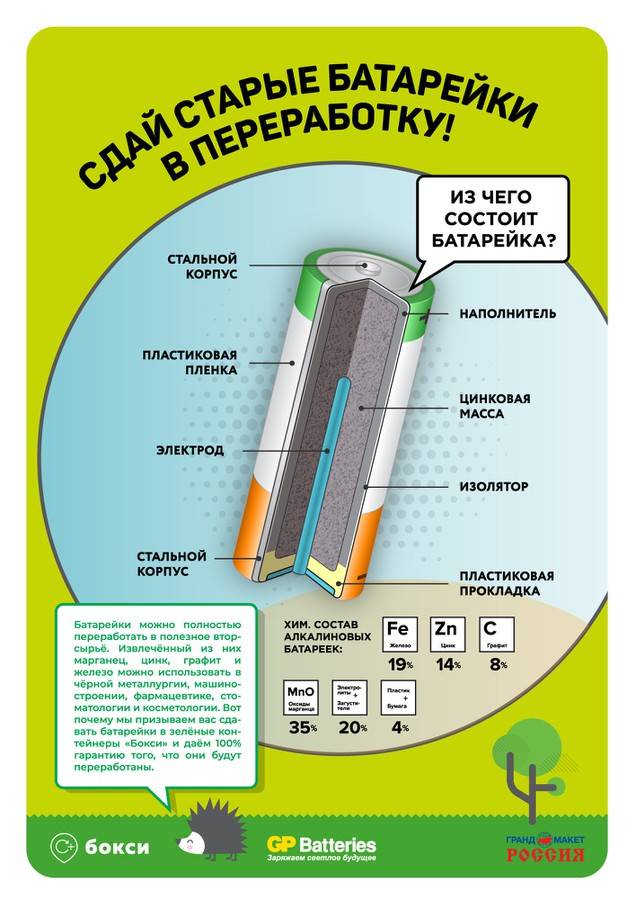
Из чего изготовлен корпус элементов питания
Корпус — один из важнейших элементов конструкции источника тока. Он выполняет защитную функцию, удерживая внутри содержимое батарейки и предотвращая её разрушение.
У каких источников питания корпус изготовлен из цинка
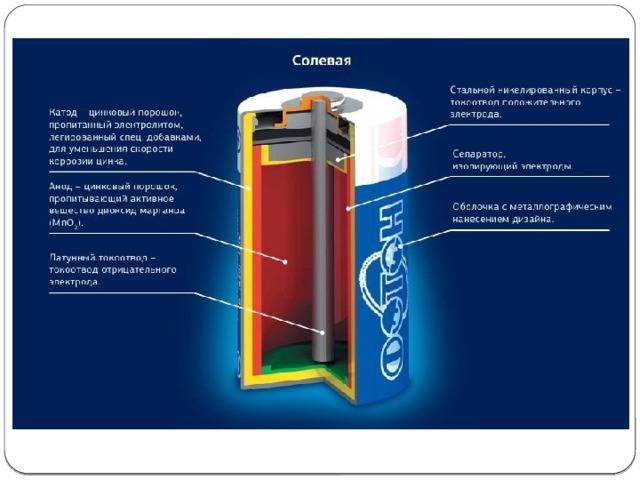
Многие неспроста задаются подобным вопросом, ведь Zn можно применять в разнообразных опытах. Или просто продать. Так, корпусом из цинка снабжены все солевые элементы питания. Обычно это непосредственно на нём и указывается.
В последнее время всё чаще можно встретить источники тока с корпусом, изготовленным из жести или железа. Материал изготовления зависит от внутренней конфигурации батареек. Железо и жесть способны обеспечить максимальную защиту и повышенную прочность.
Из чего изготавливают корпус цилиндрических батареек
Он имеет простую конструкцию, в которую входят:
- верхняя и нижняя части;
- боковая овальная часть;
- маркировка, указывающая вид источника тока.
Химический состав элементов питания
Химический состав зависит от конкретного вида источника тока. В состав большинства элементов питания входят следующие химические соединения:
- железо;
- свинец;
- марганец;
- алюминий;
- литий;
- кадмий;
- ртуть (в последнее время её стараются не использовать).
Лучшие аккумуляторные батарейки
Bmw i8: огонь, батарейка! Аккумуляторные батарейки представляют собой химические источники тока, отличающиеся от многих других, прежде всего, своим многоразовым использованием. Это связано с тем, что все химические процессы, которые в них происходят, являются обратимыми и достигается многократное циклическое использование изделий для накопления энергии. Так можно обеспечить длительную автономность разнообразных приборов и устройств.
Ventura GP 6-4.5 4.5 А·ч
Этот аккумулятор выполнен из свинца. В нем используется сухой элемент и AGM. Номинальное напряжение, которое способна обеспечить данная батарейка, достигает 6 В. Ее емкость составляет 4,5 Ач., максимальный срок службы ограничен 6 годами. Длина изделия составляет 70 мм, высота с учетом контактного провода — 107 мм, ширина — 47 мм. Подходит такая батарея для UPS и внутренней установки. Вес аккумулятора достигает 730 грамм. Производитель предусмотрел в нем вывод Ш-4.8.
Достоинства
- Значительная емкость;
- Длительный срок использования;
- Небольшие габариты;
- Возможность внутренней установки;
- Высокое номинальное напряжение.
Недостатки
- Относительно высокая цена;
- Снижение длительности эксплуатации при нарушении правил производителя.
Для того чтобы аккумулятор хорошо работал длительное время, необходимо обратить внимание на особенности его использования, которые указал производитель в инструкции по эксплуатации
Delta Gel 12-20
Устройство такого типа представляет собой герметизированный необслуживаемый свинцово-кислотный аккумулятор. Для его производства использовались несколько методов, таких как AGM+GEL: combined AGM и GEL technology. Посредством этого удалось добиться высоких зарядных характеристик и неплохой эксплуатационной устойчивости. Использоваться данные аккумуляторы могут и в буферном, и в циклическом режиме. Их можно устанавливать для обеспечения функционирования автономных энергоресурсов. Срок службы достигает 10-12 лет. Номинальная емкость при температуре 25 градусов по Цельсию после 20-часового заряда составляет 20 Ач. Саморазряд достигает 3% емкости в месяц при температуре хранения в пределах 20 градусов по Цельсию. Габариты устройства следующие: 181х77х167 мм. Вес достигает 5,22 кг.
Достоинства
- Длительный срок службы;
- Компактные габариты;
- Глубокий разряд;
- Возможность использовать с альтернативными источниками энергии;
- Небольшой вес.
Недостатки
- Сравнительно высокая цена;
- Непривычная маркировка производителя.
Батарею такого типа можно использовать в походных условиях для обеспечения работы ряда устройств.
Security Force SF 1207
Перед тем, как приобретать необходимо обратить внимание, что такие качественные аккумуляторы созданы специально для охранно-пожарных систем домов. Они являются стационарными, относятся к свинцово-кислотному типу необслуживаемых аккумуляторов. Для их производства применяется уже проверенная технология AGM
Изделия могут использоваться и в буферном, и в циклическом режиме. Срок их службы ограничен 3-6 годами. Внутреннее сопротивление заряженной на 100% батареи достигает при температуре 25 градусов Цельсия 30 мОм. Саморазряд в таких же условиях составляет 3% емкости в месяц. Габариты аккумулятора следующие: 151х65х94 мм, номинальное напряжение — 12 В. Емкость достигает 7 Ач
Для их производства применяется уже проверенная технология AGM. Изделия могут использоваться и в буферном, и в циклическом режиме. Срок их службы ограничен 3-6 годами. Внутреннее сопротивление заряженной на 100% батареи достигает при температуре 25 градусов Цельсия 30 мОм. Саморазряд в таких же условиях составляет 3% емкости в месяц. Габариты аккумулятора следующие: 151х65х94 мм, номинальное напряжение — 12 В. Емкость достигает 7 Ач.
Достоинства
- Нет ограничений на воздушные перевозки;
- Соответствие UL;
- Возможность эксплуатации в любом положении;
- Высокая плотность энергии;
- Длительный срок службы;
- Низкий саморазряд.
Недостатки
Несоответствие емкости.
Корпус аккумулятор выполнен из пластика ABS. Он отличается свойством, обеспечивающим отсутствие поддержки горения. Заряжать изделие можно от обычной розетки с напряжением 220 В.
Правильная утилизация
На всех упаковках батареек указан значок с зачёркнутым мусорным баком, который означает, что её нельзя выбрасывать вместе с остальными отходами домашнего быта. Вред возникает из-за того химического вещества, которое содержится в батарейках .
- Свинец. Наносит вред нервной системе и почкам человека.
- Кадмий. Неблагоприятно воздействует на лёгкие и мочеполовую систему.
- Ртуть. Является поражающим фактором для мозга.
- Никель. Плохо влияет на кожный покров, вызывая дерматит.
- Щелочные вещества. Наносят вред слизистым оболочкам.
В результате коррозии, металлические изделия разрушаются, что приводит к вытеканию химических элементов, попадающих в землю и затем в воду. Затем люди используют ее в качестве питьевой.
Если источник тока сожгут на заводе, то произойдёт загрязнение атмосферы. Самым опасным веществом для организма является ртуть. Она имеет свойство накапливаться в тканях живых существ.
Нельзя хранить отработанные батарейки дома, так как химические элементы попадают в воздух. В настоящее время для утилизации батареек в городах стоят специальные контейнеры, в которых хранятся использованные источники тока. Они располагаются в супермаркетах, школах, общежитиях и предприятиях. Затем их доставляют на заводы, занимающиеся переработкой батареек. Их очень мало, так как люди редко утилизируют использованный продукт в пункт приёма батареек. Они не функционируют из-за того, что не набирают необходимое число источников в день. При переработке, из вторичного сырья производят новые предметы.
Правильная утилизация также влияет на переработку вторичного сырья, а значит, меньшее количество ресурсов будет взято из окружающей среды. Тем самым наносится меньший вред экологии. Из одной переработанной батарейки получится один грифель для карандаша. Из металлов производят столовые приборы (ножи, вилки, ложки).
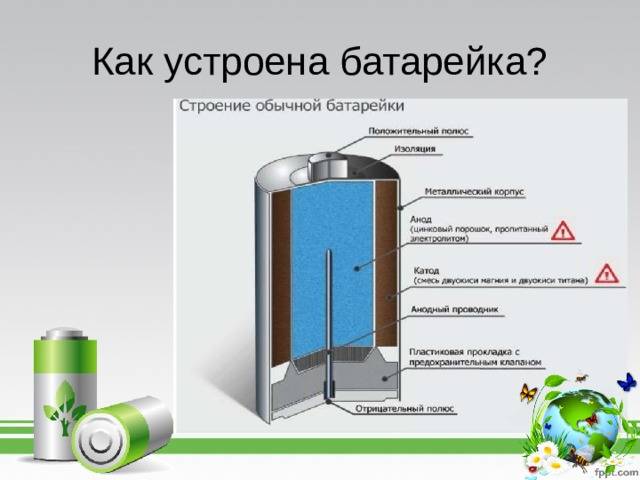
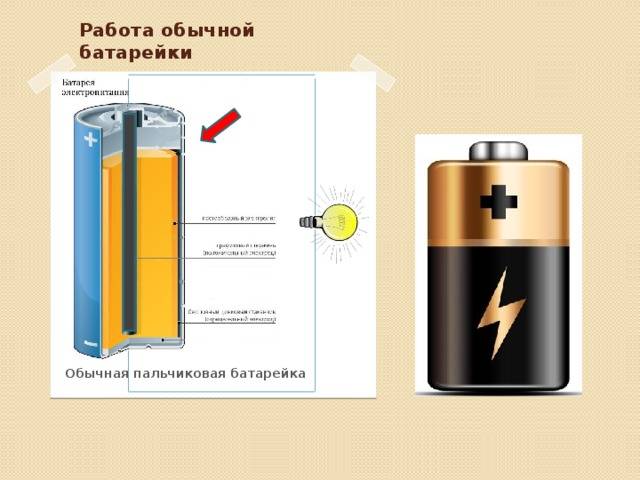
Как работает батарейка
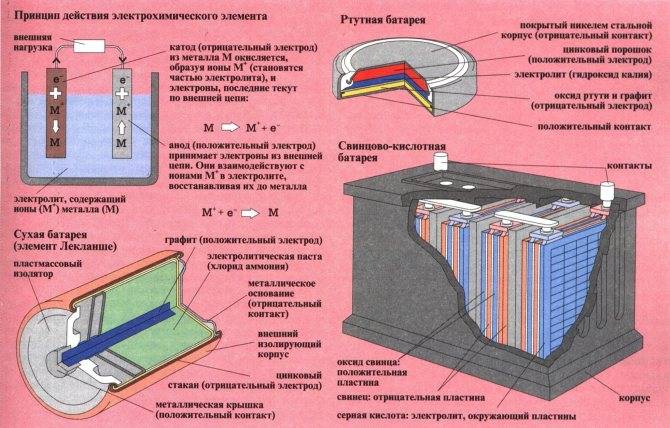
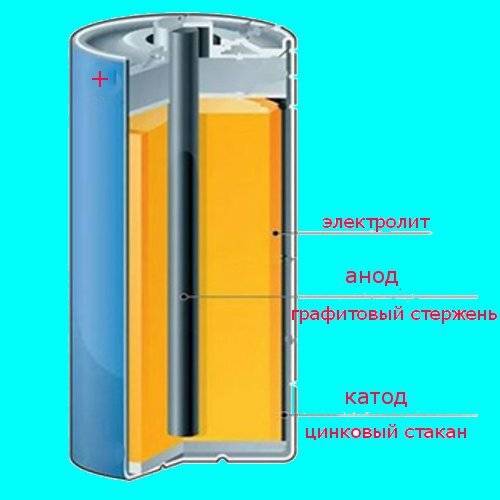
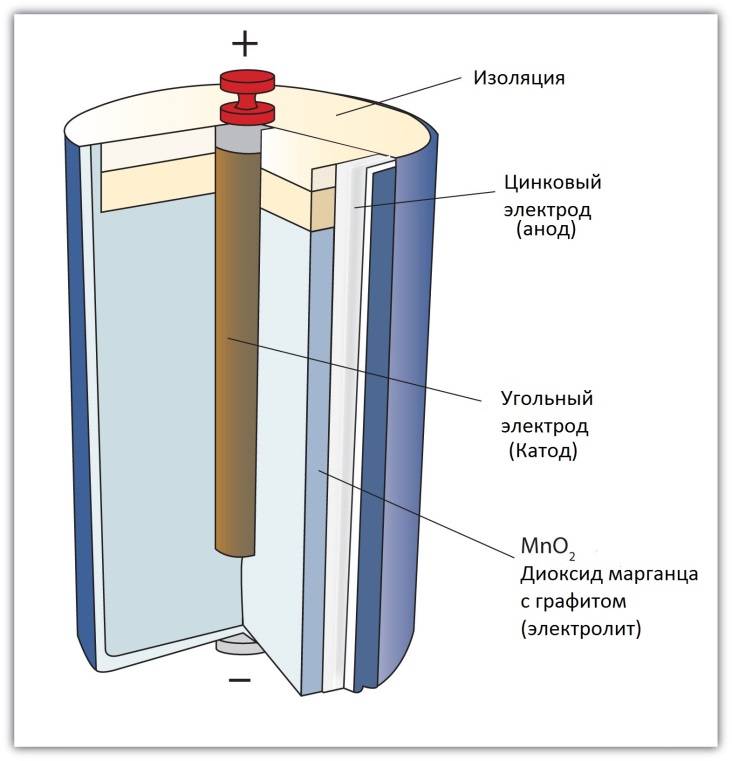
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
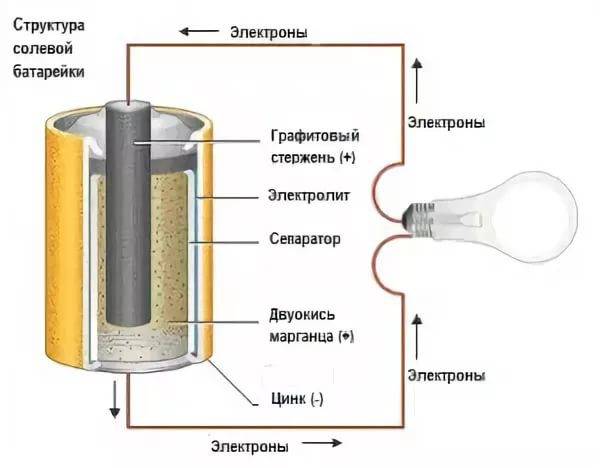
- Отрицательно заряженные ионы гидроксида (2OH-) взаимодействуют с цинком (Zn) в анодной секции. В результате химической реакции окисления получается гидроксид цинка (Zn(OH)2) и высвобождаются молекула воды и отрицательно заряженные электроны. Эти электроны теперь свободны для перемещения, и они собираются на латунном штыре (токоотводе отрицательного электрода).
- В то же время диоксида марганца (2MnO2) соединяется с молекулой воды (H2O) из электролита, а также со свободным электроном. Во время такой химической реакции восстановления диоксид марганца превращается в оксид марганца (Mn2O3). Оксид марганца больше не нуждается в атоме гидроксид-иона, поэтому он будет выбрасывать его в электролит.
- Таким образом, появляется скопление электронов на отрицательном конце батарейки. Поскольку больше отрицательно заряженных электронов на отрицательном полюсе по сравнению с положительным, образуется разность напряжений между ними, и эту разность можно измерить с помощью мультиметра.
- Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. Но сепаратор не позволяет им течь внутри батареи, чтобы достичь положительной клеммы. Если обеспечить электронам внешний путь (например подключив лампочку), то электроны будут течь через него и выполнять работу (заставлять лампу светится).
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
История обыкновенной батарейки
Слово «батарея», происходящее от французского слова «batterie», давно вошло в русский язык.
Название происходит от артиллерийской батареи, как исторически первого типа батарей. Впоследствии название стало употребляться для обозначения соединения однотипных предметов вообще.
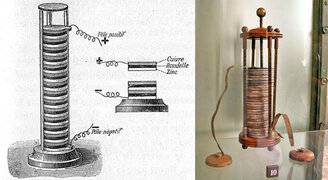
Официальное рождение батареи относят к 1800 г., когда итальянский физик Алессандро Вольта, основываясь на опытах итальянского врача и анатома Луиджи Гальвани, сделал устройство, получившее впоследствии название «вольтов столб». Сложив стопку высотой полметра из пластинок цинка, меди и войлока, смоченного раствором серной кислоты, Вольта, приложив руки к концам стопки, получил весьма чувствительный удар током. Так началась электрическая эра.
Изобретение Алессандро Вольта произвело фурор в обществе, Вольта осыпали почестями и наградами, его именем назвали единицу электрического напряжения. Свою долю славы получил и Луиджи Гальвани. В его честь электрохимический элемент, изобретенный Вольта, называется гальваническим.
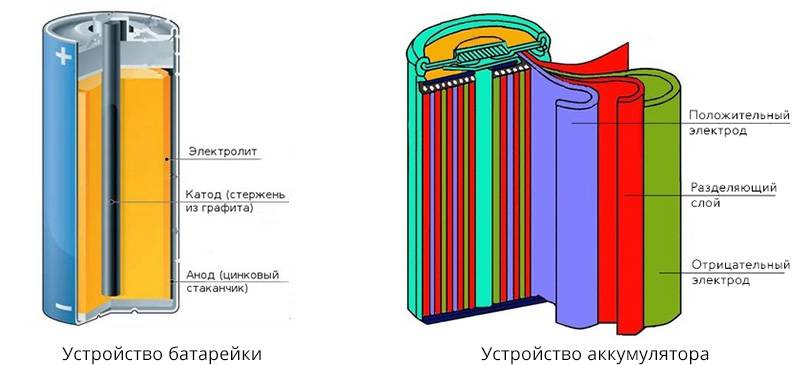
Гальванические элементы делятся на два типа – первичные и вторичные.
Все батарейки являются первичными гальваническими элементами.
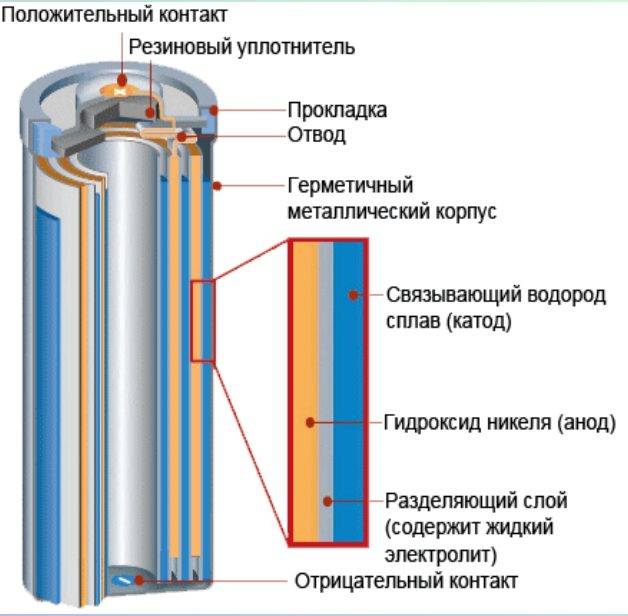
Вторичные гальванические элементы – элементы, в которых электрическая энергия от внешнего источника тока превращается в химическую энергию и накапливается, а затем, при необходимости, химическая энергия снова превращается в электрическую. Эти вторичные элементы называются аккумуляторами.
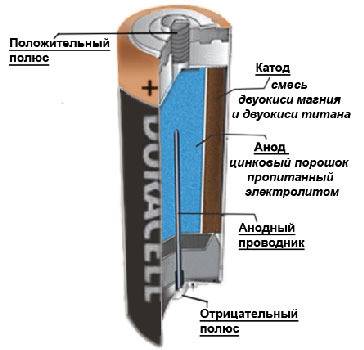
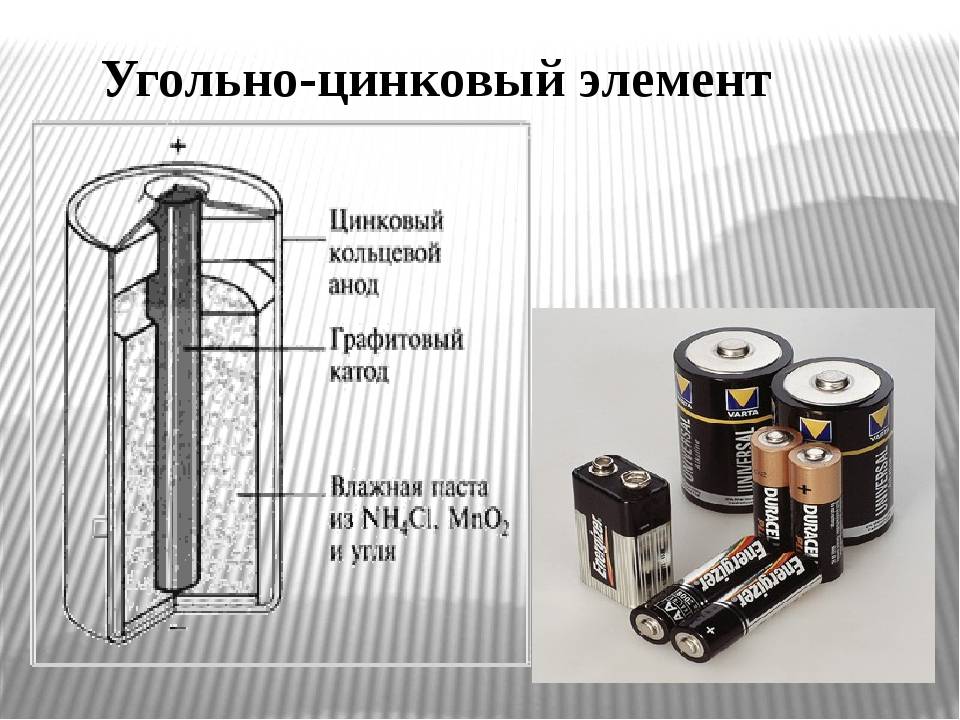
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, был изобретен Жоржем Лекланше в 1866 году.
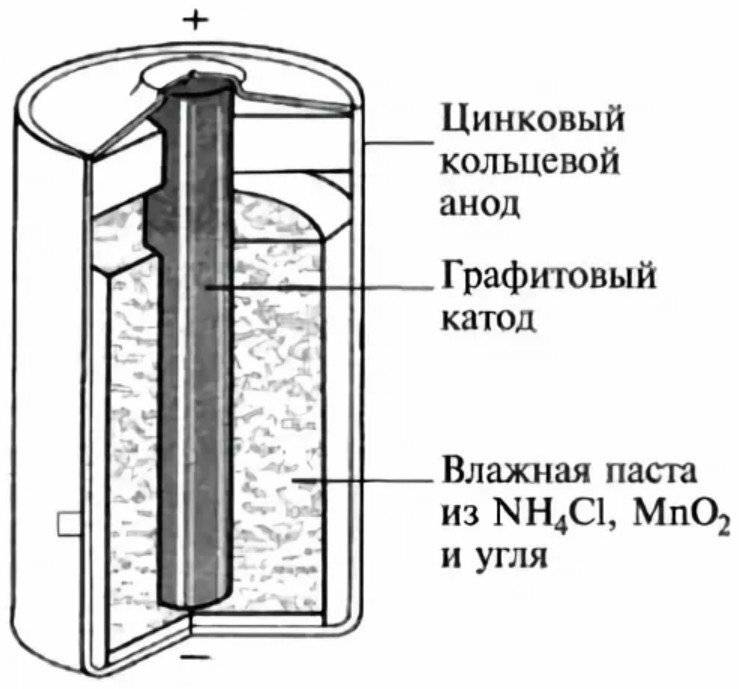
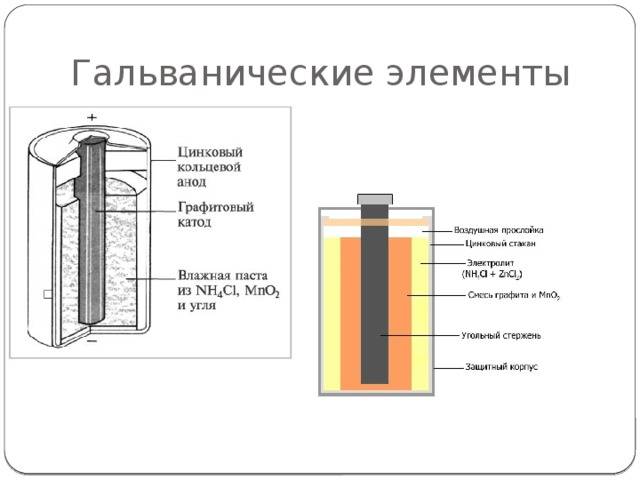
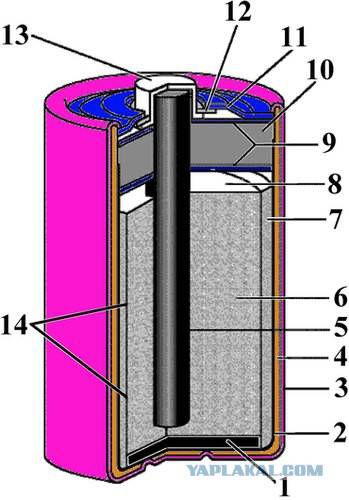
Конструкция имени Лекланше проста – цинковый анод, катод из диоксида марганца с углем, размещенные в электролите из хлорида аммония, т.е. соли аммония.
В течении некоторого времени элемент Лекланше претерпел изменения: цинковый анод стал делаться в виде цинкового стаканчика, в стаканчике размещен катод из смеси диоксида марганца и графита, в центре катода находится угольный стержень, являющийся токосъемником, катод окружен электролитом из хлорида аммония с добавкой хлорида цинка, только не в жидком виде, как у Лекланше, а в загущенном, в виде геля, из-за добавления крахмала и муки. Это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента.
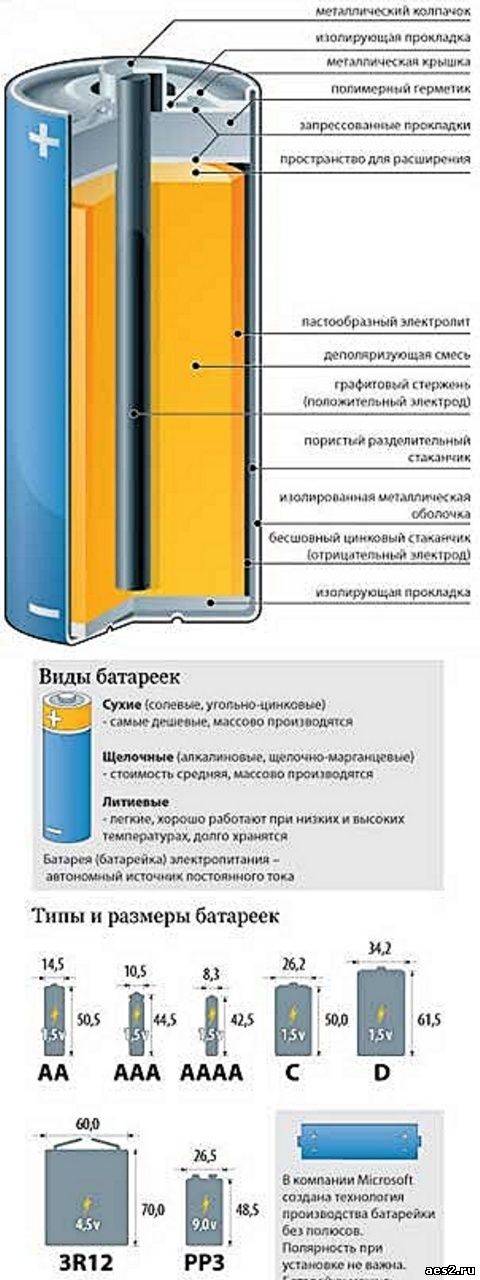
Элементы с загущенным электролитом получили название «сухие батареи».

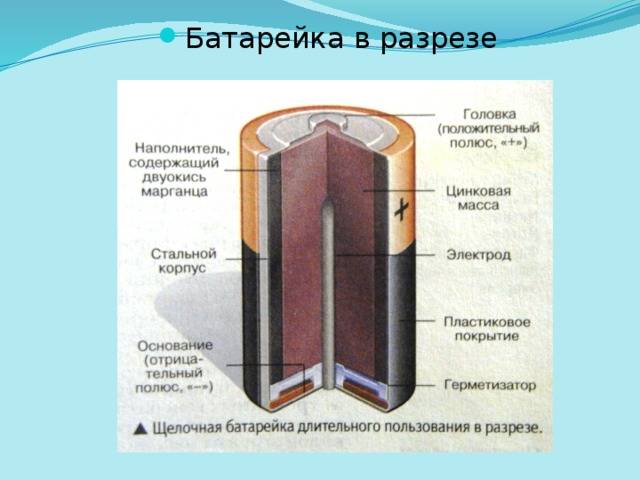
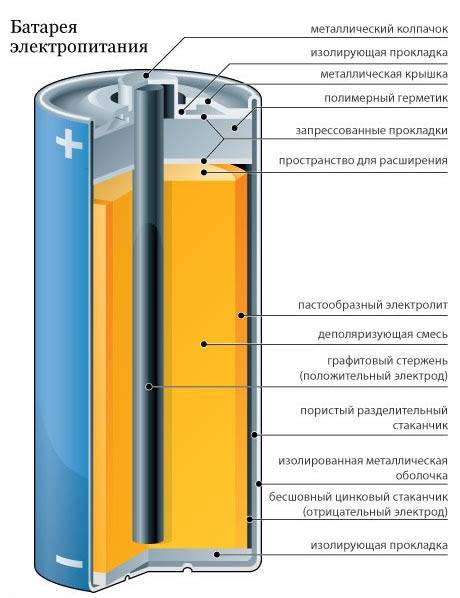
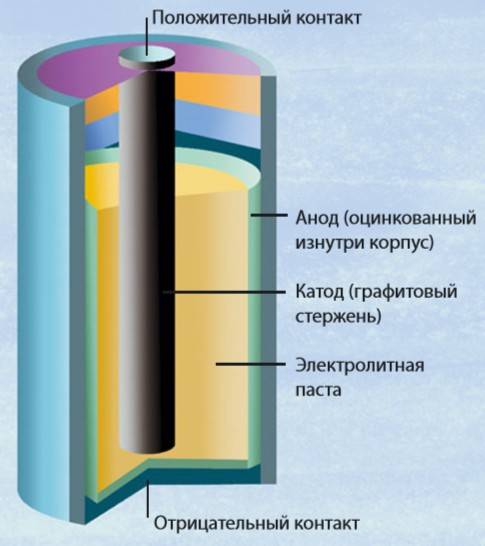
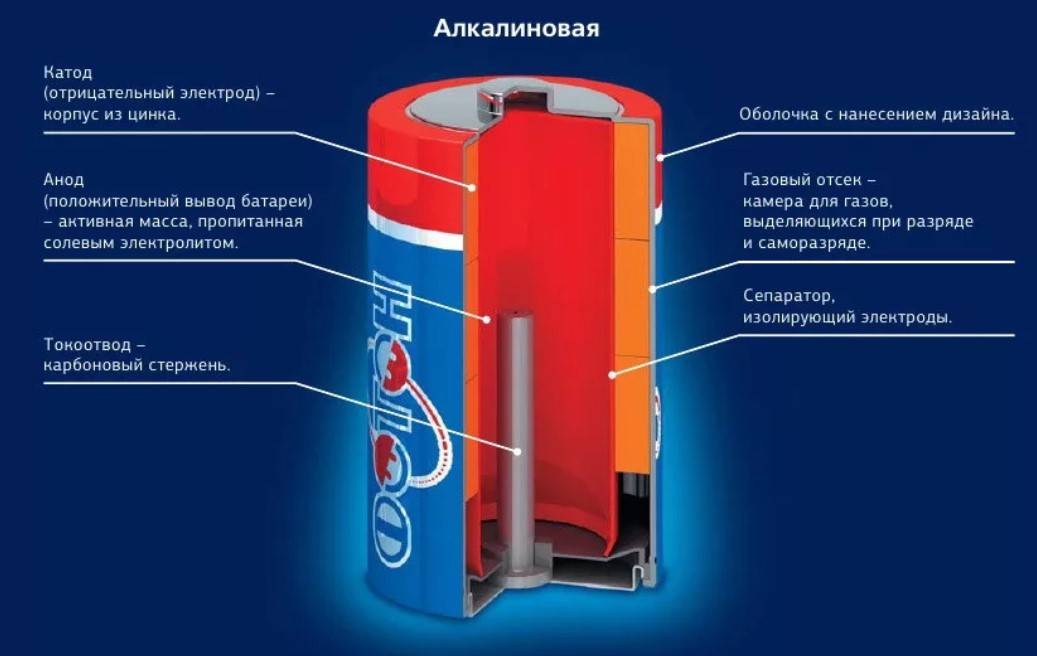
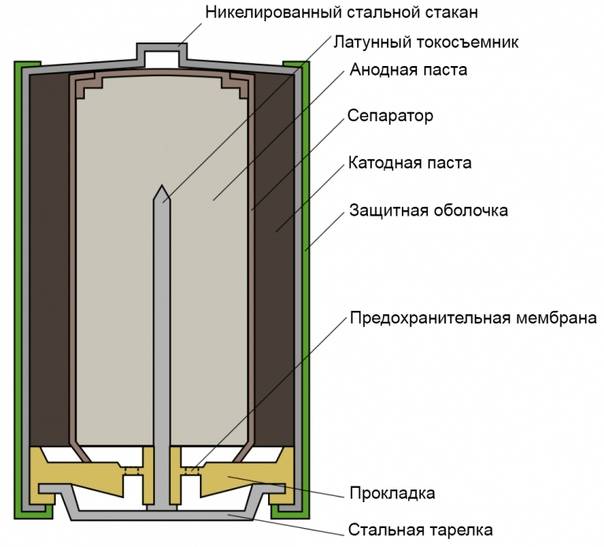
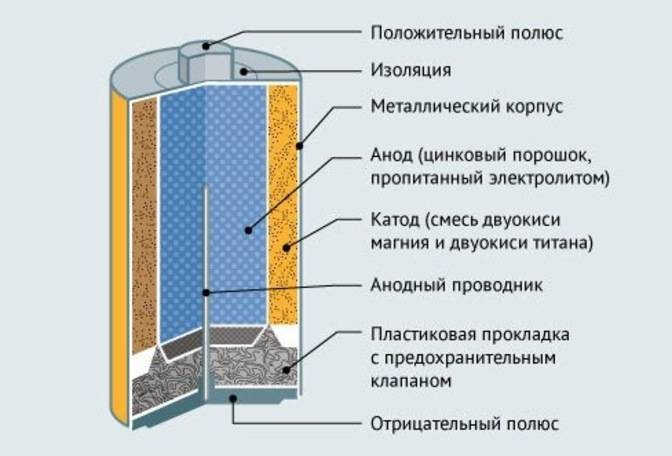
Одним из всплесков было появление щелочных батарей. Впервые щелочные батарейки выпустила компания Eveready (ныне Energizer) в 1959г. Принцип ее работы практически идентичен принципу работы солевой батареи – анод из цинка, катод из диоксида марганца, единственное отличие в составе электролита – он не из соли аммония, как в солевой, а из раствора щёлочи, обычно гидроксида калия. У щелочной батареи анод в виде пасты из цинкового порошка в смеси с электролитом находится внутри катода из смеси диоксида марганца с графитом.
Анод и катод разделены тонким сепаратором, пропитанным электролитом, и все это располагается в стальном корпусе. Получается, что если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента все наоборот, корпус (+), а центральный токоотвод (-).
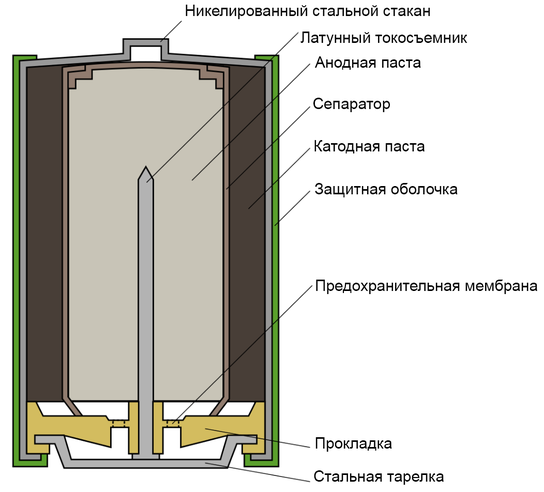
Такая конструкция, разумеется, сделана не просто так. В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент – анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Форм-фактор распространенных гальванических элементов
Виды батареек по размерам
Батарейки с одним и тем же химическим составом могут иметь разный размер и форму (типоразмер). Мы составили для вас таблицу-шпаргалку по типоразмерам батареек, чтобы вы точно разобрались, батарейки AA и AAA — это пальчиковые и мизинчиковые?
Цилиндрические батарейки
| Типоразмер | Бытовое название | Ширина, мм | Высота, мм | Возможный химический состав | Внешний вид |
| A (23) | Мини-мизинчиковая | 10,5 | 28,9 | Солевые, щелочные |  |
| AA (03) | Пальчиковая | 14,5 | 50,5 | Солевые, щелочные, литиевые |  |
| ААА (6) | Мизинчиковая | 10,5 | 44,5 | Солевые, щелочные, литиевые |  |
| AAAA (40) | Маленькая мизинчиковая | 8,3 | 42,5 | Солевые, щелочные |  |
| С (14) | Средняя | 26,2 | 50 | Солевые, щелочные |  |
| D (20) | Большая | 34,2 | 61,5 | Солевые, щелочные |  |
| РР3 | Крона | 26,5 | 48,5 | Солевые, щелочные, литиевые |  |
Замена отжившей цилиндрической батарейки, таким образом, не представляет особой трудности. Достаточно сопоставить маркировку химического состава и типоразмера — и она должна быть представлена на корпусе нужной вам батарейки. Например:
- R23 — солевая A;
- LR03 — щелочная AA;
- СR6 — литиевая AAA.
А вот ртутные и серебряные элементы, как правило, представлены в круглом формате — ее в быту называют «таблеткой». Круглые батарейки имеют великое множество типоразмеров, не подчиняющихся единому стандарту.

На фото — многочисленные размеры круглых батареек.
Производители выпускают их такого размера, как им угодно, поэтому замена отжившей батарейки часто представляет заметную проблему. Впрочем, хорошо то, что использование таких элементов ограничено крайне узким кругом устройств. Наша рекомендация: прочтите маркировку на корпусе батарейки и поищите элементы с аналогичной маркировкой в интернете или ближайшем магазине.
Плотность энергии
Объём самого аккумулятора, его номинальная ёмкость и накапливаемая энергия в разобранных смартфонах складываются в несколько интересных тенденций.
Объём почти не изменился
Объём батареи за всю историю эволюции смартфонов практически всегда остаётся на одном уровне, немного увеличиваясь в топовых флагманских моделях и планшетофонах с большим экраном (например, серия Samsung Galaxy Note или линейка фаблетов iPhone Plus).
Жёсткий каркас заменили на мягкую оболочку
Применение дизайна «пакетных элементов» (в полимерной или фольгированной оболочке) не привело к уменьшению размера батарей.
При всём при этом ёмкость увеличивается
Номинальная ёмкость батареи увеличилась по мере совершенствования литий-ионной и литий-полимерной технологий и роста потребности в энергии аппаратной начинки смартфонов.
Сформировалась уверенная тенденция к увеличению плотности энергии батареи смартфона. В период с 2012-го по 2019-й средний показатель вырос примерно на 50%. Вполне вероятно, в 2020-м и 2021-м годах производители представят разработки для ещё большего уплотнения энергии в существующих габаритах аккумуляторов.
Стоит ли заменять батарейки на аккумуляторы
В быту, кроме детских игрушек, инструмента, фонариков, которые можно гонять с утра до вечера у аккумуляторов совсем нет преимуществ по сравнению с батарейками.
К тому же учитывайте, что у классических пальчиковых никельметаллгидридных аккумуляторов напряжение ниже, порядка 1.25 Вольта, что при падении всего на 0.25 Вольта вызовет паралич у вашего устройства. Для микропотребляющей техники совсем не подходят, так как имеют саморазряд десятки процентов в год, т.е. они рассчитаны на постоянное использование в течении короткого промежутка времени!
Обратите внимание, что литиевые батарейки — это не аккумуляторы и их нельзя заряжать! В лучшем случае все закончиться обычным шипящим звуком, в другой ситуации возможен взрыв и/или возгорание батареи. Изделие предназначено для однократного использования, не пытайтесь восстановить!. Свинцовые аккумуляторы мало пригодны для классических бытовых задач, поэтому противопоставлять их батарейкам технически не конструктивно
Свинцовые аккумуляторы мало пригодны для классических бытовых задач, поэтому противопоставлять их батарейкам технически не конструктивно.
Как делают батарейки?
Производство батарей начинается с нарезки пластинок из стали в овальные детали. Дальше выполняется сворачивание в металлическую трубочку. Которая затем будет именоваться корпусом. В него помещают химические составляющие, такие как графит, серебряный катализатор, диоксид марганца, сульфат бария, цинк, загуститель, гидрооксид калия. Устройство батарейки не всегда бывает простым.
Дальше пресс скатывает химикаты катода в гранулы. После этого на корпус наноситься бороздка для того, чтобы упростить запайку. Затем на отрицательный полюс наноситься герметик. Параллельно с этим на другом станке идет нарезка перфорированной бумаги. Производиться нанос клея около минусового полюса. Пока корпус передвигается по конвейеру клей высыхает.
Затем производиться впрыскивание гидрооксида калия или электролита. Далее в полость анода впрыскивается цинковый гелий. Цинк придает гелию серебристо белый цвет. Сварочный станок приваривает 4-и сантиметровых гвоздя к крышке батареи. Там будет скапливаться заряд прежде чем разрядиться. После происходит закрытие отрицательного полюса. Затем все края загибаются, и энергетический элемент становиться похожим сам на себя.
Специальный электронный станок проверяет каждый элемент питания на брак и наличие заряда в 1,5 вольт. Дальше остается сделать контрольный штрих приклеить наклейку. Как только это будет сделано каждому источнику питания предстоит пройти через печь. Температура в подобном устройстве 198 градусов, и они будут там находиться всего 3 секунды. Это нужно для того чтобы наклейка хорошо закрепилась.
Классификация по типу электролита (упрощённая)[править | править код]
| Тип | Достоинства | Недостатки |
|---|---|---|
| Сухие(«солевые», угольно-цинковые) | Самый дешёвый, массово производится. | Наименьшая ёмкость; спадающая кривая разряда; плох в работе с мощными нагрузками (большим током); плох при низких температурах. |
| Heavy Duty(«мощный» сухой элемент, хлорид цинка) | Дешевле, чем щелочной. Лучше при высоком токе и низких температурах. | Низкая ёмкость. Спадающая кривая разряда. |
| Щелочные(«алкалиновые», щёлочно-марганцевые) | Средняя стоимость. Лучше предыдущих при большом токе и низких температурах. При разряде сохраняет низкое значение полного сопротивления. Широко выпускается. | Спадающая кривая разряда. |
| Ртутные | Постоянство напряжения, высокая энергоёмкость и энергоплотность. | Высокая цена. Из-за вредности ртути уже почти не производятся. |
| Серебряные | Высокая ёмкость. Пологая кривая разряда. Хорош при высоких и низких температурах. Превосходная длительность хранения. | Дорогой. |
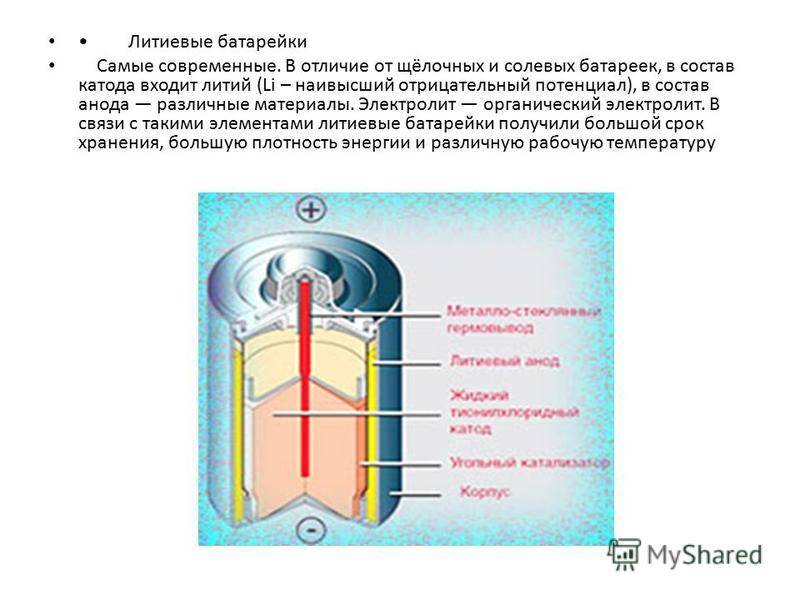
| Литиевые | Наивысшая ёмкость на единицу массы. Пологая кривая разряда. Превосходен при низких и высоких температурах. Чрезвычайно длительное время хранения. Высокое напряжение на элемент (3,5—4,2 В у аккумуляторных батарей; 1,5 или 3,0 В у батарей литиевых элементов). Лёгкий. | Дорогой. |
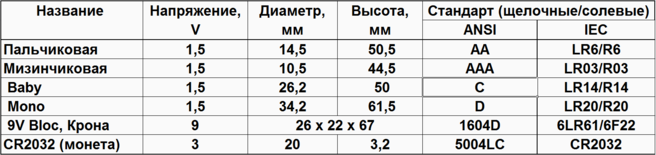
Форм-фактор распространенных гальванических элементов
| Название | Напряжение, V | Диаметр, мм | Высота, мм | Стандарт (щелочные/солевые) | |
| ANSI | IEC | ||||
| Пальчиковая | 1,5 | 14,5 | 50,5 | AA | LR6/R6 |
| Мизинчиковая | 1,5 | 10,5 | 44,5 | AAA | LR03/R03 |
| Baby | 1,5 | 26,2 | 50 | C | LR14/R14 |
| Mono | 1,5 | 34,2 | 61,5 | D | LR20/R20 |
| 9 V Bloc, Крона | 9 | 26 × 22 ×67 | 1604D | 6LR61/6F22 | |
| CR2032 (монета) | 3 | 20 | 3,2 | 5004LC | CR2032 |
Подведем итог. Гальванический элемент (батарейка) — это источник электрического тока, основанный на химической реакции двух металлов (или их оксидов). Один из металлов (анод) всегда более активный, чем второй (катод). Анод и катод помещены в токопроводящую среду (электролитом). При соединении концов элемента проводником образуется электрическая цепь, начинает вырабатываться ток, который бежит от анода (-) к катоду (+). Несмотря на то, что реальные переносчики заряда (электроны) перемещаются от «минуса» к «плюсу», принято считать, что ток течет от «плюса» к «минусу» (так исторически сложилось).
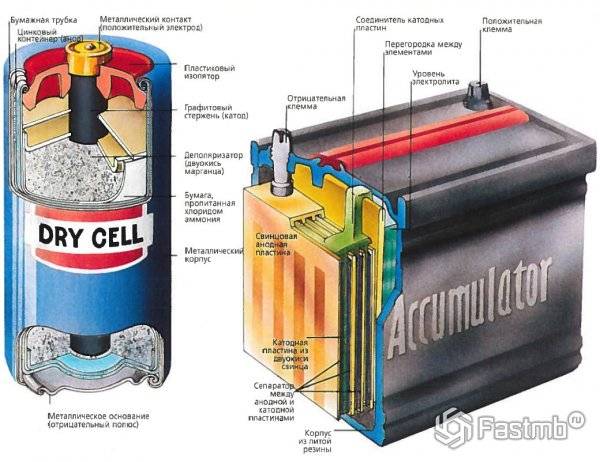
Свинцово-кислотный аккумулятор

Свинцово-кислотный автомобильный аккумуляторНапряжение: 2,1 В номинальное
До того, как все экологичные, энергосберегающие аккумуляторы стали популярными, свинцово-кислотные аккумуляторы лидировали на рынке. Первоначально изобретенный французским физиком Гастоном Планте в 1859 году, свинцово-кислотные батареи стали хитом ранних электромобилей.
Полностью заряженная свинцово-кислотная батарея несет гелеобразный свинец на отрицательном конце (электрод) и диоксид свинца на положительном конце с серной кислотой в качестве электролита. Электричество вырабатывается, когда ионы от отрицательной клеммы перемещаются в электролит, а затем поглощаются положительной клеммой. Обратная реакция происходит при зарядке.
Свинцово-кислотные батареи обычно используются в автомобильной промышленности для зажигания и освещения. Другие применения включают резервный источник питания в телефонных вышках.
Однако, эти батареи гораздо вреднее, чем другие. Токсичные соединения, выделяемые из свинцово-кислотных аккумуляторов, находятся в центре внимания природоохранных учреждений во всем мире на протяжении последних двух десятилетий.